■ 몰(mole) 의 개념
■ 화학식과 화학반응식
▶ 아보가르드로 수와 몰(mol)
▷ 아보가르도 수 ( Avogadro's Number )
1811년 아보가드로의 분자설, 같은 부피 속에 들어있는 기체의 분자 수는
기체의 종류에 관계없이 모두 같다는 분자설이다.
1909년 장 폐랭이 아보가드로 수를 최초로 결정, 분자의 존재를 처음 제안한 아보가드로를
기리기 위해 아보가드로 수라 불리었다
2019년 이전에는 탄소(C) 를 기준으로 정의되었음
아보가드로 수[Na] = 6.02214076 x 10^23
▷ 몰(mole)
몰(mole)의 단위는 mol이며, 입자(원자, 분자, 전자, 이온) 의 개수를 세는 단위이다
아보가드로 수 개의 입자로 구성된 물질의 양이다
어떤 입자가 6.02214076 x 10^23 개만큼 있을 때, 이것을 1[mol] 이라고 정의한다

모든 원소에 대하여 몰(mol)질량 = 원자 질량(gram)
1 amu = 1 / NA [g] , 1 [amu] = 1.66054 x 10^-24 [g]
▶ 분자량과 몰질량
▷ 물( H2O) 의 분자량과 물질량
1 [amu] x 2 + 16 [amu] = 18 [amu]
18 [amu] x NA = 18 [g]
→ 360 [g] 의 물(H2O) 는 몇 몰(mol) 일까 ?
물 1 [mol] 은 = 18 [g]
x [mol] = 360 [g]
x = 360 / 18 = 20 [mol]
▷ 에탄올(C2H5OH)의 분자량과 물질량
12 [amu] x 2 + 1 [amu] x 6 + 16 [amu] = 46 [amu]
46 [amu] x NA = 46 [g]
→ 500 [g] 의 에탄올(C2H5OH) 는 몇 몰(mol) 일까 ?
에탄올 1 [mol] 은 = 46 [g]
x [mol] = 500 [g]
x = 500 / 46 = 10.87 [mol]
▷ 질량으로부터 분자 개수 계산
[Q] 100 [g] 의 물(H2O) 에는 물 분자 몇 개가 포함되어 있을까?
x = 100 [g] / 18 [g/mol] = 5.556 [mol]
1 [mol] = 6.02214076 x 10^23
5.556 [mol] = x개
x = 3.3456 x 10^24
▷ 몰(mol) 부피
[Q] 4'C 에서 물(H2O) 의 밀도가 1.00[g/mL] 라면 4'C 에서 물의 몰(mol) 부피는 얼마일까?
몰(mol) 부피 : 어떤 물질 1(mol) 의 부피
→ 물 1[mol] = 18 [g]
밀도 = 질량 / 부피
물의 몰(mol) 부피 = 몰(mol)질량 / 밀도 = 18 [g] / 1.00 [g/mL] = 18 [mL]
[Q] 20'C 에서 에탄올의 밀도가 0.79[g/mL] 라면 20'C 에서 에탄올의 몰(mol) 부피는 얼마일까?
몰(mol) 부피 : 어떤 물질 1(mol) 의 부피
→ 물 1[mol] = 46 [g]
밀도 = 질량 / 부피
물의 몰(mol) 부피 = 몰(mol)질량 / 밀도 = 46 [g] / 0.79 [g/mL] = 58.2 [mL]
▶ 실험식과 분자식
▷ 화학식, 분자식, 실험식의 개념
화학식은, 화합물의 조성을 표현하는 방법이다. 화합물을 구성하는 원자의 종류와 수를 나타낸 것
분자식은, 분자를 이루는 성분 원소들의 원자 개수를 정확히 표현한 것, 물의 분자식 = H2O
실험식은, 화합물을 구성하는 원소들의 개수를 가장 간단한 정수비로 표현한 것이다
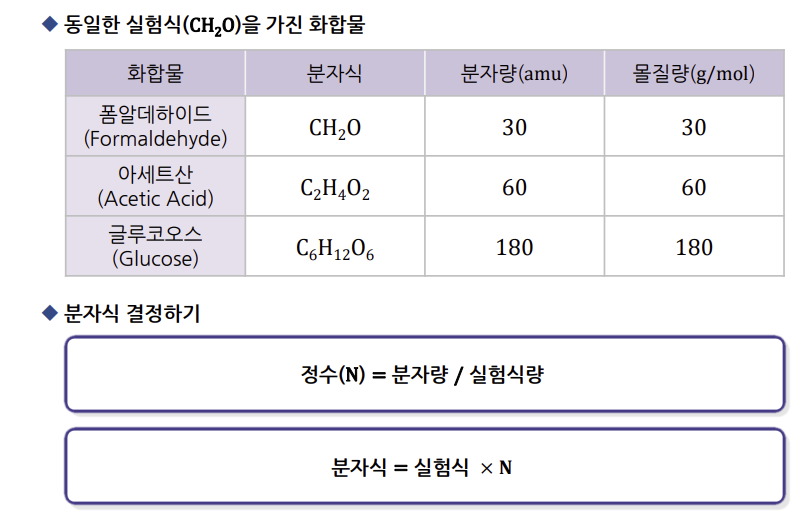
글루코오스 분자식의 결정
→ 글루코오스(C6 H12 O6) 의 분자량 : 180 [amu]
글루코오스 실험식(C H2 O) 의 실험식량 : 30 [amu]
N = 180 / 30 = 6
분자식 : C H2 O x 6 = C6 H12 O6
[Q] 원소분석법을 이용하여 물질량이 90 [g/mol] 인 유산(Lactic Acid)의 성분 원소 질량
백분율을 측정하여 다음과 같은 결과를 얻었다. 유산의 실험식과 분자식은 무엇일까?
탄소(C) : 40.0[%] / 수소(H) : 6.7[%] / 산소(O) : 53.3[%]
유산(Lactic Acid) 이 100 [g] 이 있다고 가정하면
탄소의 질량 = 100 [g] x 40.0 [%] = 40 [g]
→ 탄소의 몰(mol) 수 : 40 [g] / 12 [g/mol] = 3.33 [mol]
수소의 질량 = 100 [g] x 6.7 [%] = 6.7 [g]
→ 수소의 몰(mol) 수 : 6.7 [g] / 1.008 [g/mol] = 6.66 [mol]
산소의 질량 = 100 [g] x 53.3 [%] = 53.3 [g]
→ 산소의 몰[mol] 수 : 53.3 [g] / 16 [g/mol] = 3.33 [mol]
탄소 몰(mol)수 : 3.33 [mol] / 수소 몰(mol) 수 : 6.66 [mol] / 산소 몰(mol) 수 : 3.33 [mol]
탄소 : 수소 : 산소 = 1 : 2 : 1
실험식 : C H2 O
실험식량 : 12 [amu] + 2 [amu] + 16 [amu] = 30 [amu]
분자량/실험식량 : 90 [amu] / 30 [amu] = 3
→ 분자식 : C H2 O x 3 = C3 H6 O3
▶ 화학반응식
화학반응을 표현하기 위한 방법, 보통 화살표를 기준으로 하여
왼쪽에는 반응물, 오른쪽에는 생성물을 표기한다
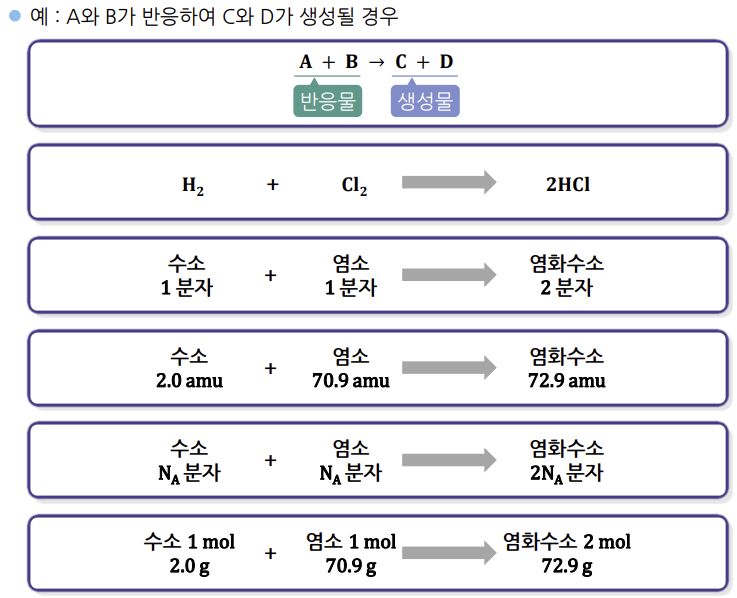
▶ 한계반응물
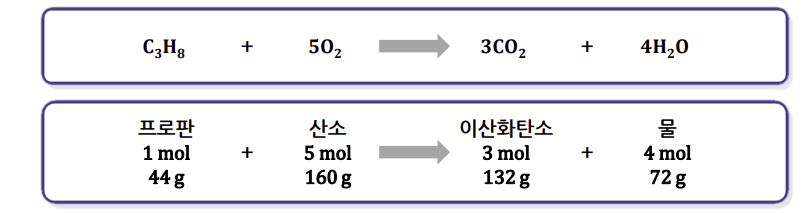
화학양론계수 : 프로판은 1, 산소는 5 로
반응 시 프로판과 산소는 1 : 5 의 비로 반응한다
프로판 1 [mol] (44g) 을 모두 연소시키기 위해서는 산소 5 [mol] (160g) 이 필요하다
'화학(Chimestry)' 카테고리의 다른 글
| (1) [ 화학 기초 이론 ] 물질을 구성하는 원자 (0) | 2024.07.04 |
|---|
